Зачем учёные выращивают в лаборатории крошечные мозги
«Крошечная живая модель человеческого мозга, которая растёт в чашке Петри» — звучит как научная фантастика. Однако такие эксперименты вполне реальны. Учёные называют их «мозговыми органоидами», и это одно из самых больших достижений современной биомедицины. Расскажем, как создают такие «мини-мозги», зачем они нужны науке и какие большие этические вопросы ставят эти маленькие органы перед людьми.

Что такое органоид мозга и как его делают
Органоид мозга — это трёхмерный комок клеток, выращенный из стволовых клеток человека. Он не способен мыслить, но может воспроизводить базовую структуру и клеточный состав настоящего эмбрионального мозга. Внутри него есть разные типы нейронов, астроциты и другие важные клетки центральной нервной системы. Именно поэтому учёные предпочитают строгий термин «органоид» вместо «мини-мозга», чтобы не вводить людей в заблуждение.
Главная ценность органоидов в том, что они решают проблемы старых исследовательских методов. Раньше у учёных было два основных пути изучения процессов внутри человеческого мозга:
- 2D-культуры. Это клетки, которые растут плоским слоем на дне чашки. Они не могут воссоздать сложную трёхмерную архитектуру мозга.
- Животные модели. Мозг мыши или обезьяны — это 3D-система, но он сильно отличается от человеческого. Это мешает изучать специфически человеческие болезни, например шизофрению или аутизм.
Органоиды лишены недостатков обоих методов: они трёхмерные, как у животных, но при этом выращены из человеческих клеток.
Как выращивают органоиды
Процесс выглядит так:
- Исходный материал. Основой служат плюрипотентные стволовые клетки человека. Чаще всего используют так называемые индуцированные плюрипотентные стволовые клетки (iPSCs). Их главное преимущество в том, что их можно получить из клеток кожи или крови взрослого человека. Это снимает этические вопросы, связанные с эмбрионами, и открывает дорогу к персонализированной медицине.
- Формирование агрегатов. Стволовые клетки собирают в крошечные шарики — «эмбриоидные тела».
- Запуск «мозговой программы». Эти шарики помещают в специальную питательную среду с факторами роста и малыми молекулами. Эти вещества «убеждают» клетки начать развиваться по пути превращения в ткань мозга. Процессом можно управлять, чтобы получить органоиды, имитирующие конкретные отделы мозга, например кору или гиппокамп.
- Рост в 3D. Чтобы органоид рос и получал достаточно кислорода и питательных веществ, его помещают в специальный гель и вращающийся биореактор.
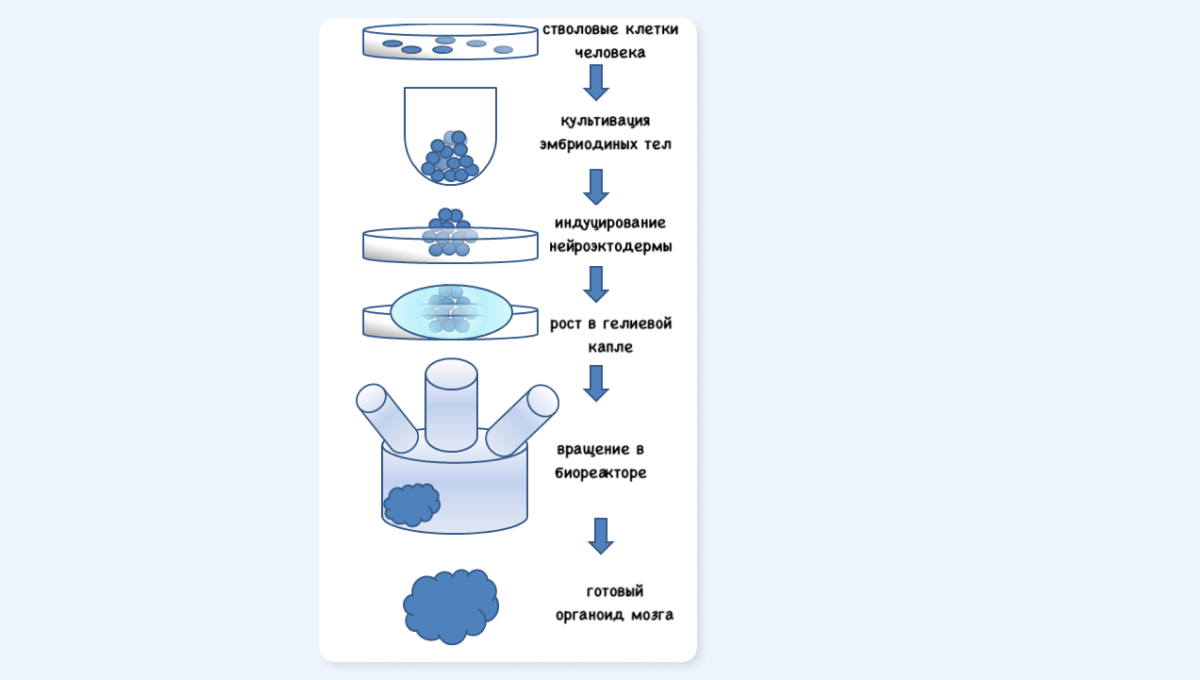
Схема процесса получения мозговых органоидов
В результате через несколько месяцев вырастает структура, в которой клетки организованы в слои, похожие на кору головного мозга плода, и даже формируют сложные нейронные сети.
Зачем нужны «мини-мозги»? Три главные цели
Учёные создают органоиды мозга не просто ради научного любопытства. У этих биологических структур есть три важные сферы применения, которые могут изменить медицину и понимание учёными человеческого организма.
Изучение болезней
Многие неврологические заболевания невозможно адекватно смоделировать на животных. Органоиды, выращенные из клеток пациентов, позволяют в буквальном смысле наблюдать за развитием болезни в чашке Петри. Вот лишь несколько примеров заболеваний, которые можно исследовать при помощи органоидов мозга:
- Расстройства аутистического спектра (РАС) и шизофрения. Органоиды от пациентов с этими диагнозами помогли выявить дисбаланс между возбуждающими и тормозящими нейронами и другие клеточные нарушения, лежащие в основе этих состояний.
- Болезнь Альцгеймера. В органоидных моделях удалось воспроизвести ключевые признаки болезни — накопление бета-амилоида и тау-белка, что было большой проблемой в мышиных моделях.
- Вирус Зика. Именно на органоидах учёные наглядно показали, как вирус Зика поражает клетки-предшественники нейронов, что приводит к уменьшению размера мозга (микроцефалии) у новорождённых.
Тестирование лекарств
Разработка новых препаратов — долгий и дорогой процесс, и многие соединения, показавшие себя успешными на животных, проваливаются в клинических испытаниях на людях. Органоиды могут стать ключевым промежуточным этапом для проверки эффективности и токсичности лекарств на человеческих клетках.
Более того, технология iPSCs позволяет создать органоид для конкретного пациента и проверить, какой из препаратов будет наиболее эффективен именно для него. Это и есть настоящий прорыв к персонализированной медицине, где лечение подбирается под уникальный генетический профиль человека.
Понимание устройства мозга
Помимо болезней, органоиды дают уникальную возможность изучать фундаментальные процессы развития нашего мозга: как рождаются нейроны, как они мигрируют в нужные места и формируют сложные связи. Учёные могут буквально в реальном времени наблюдать за процессами, которые раньше были скрыты от глаз.
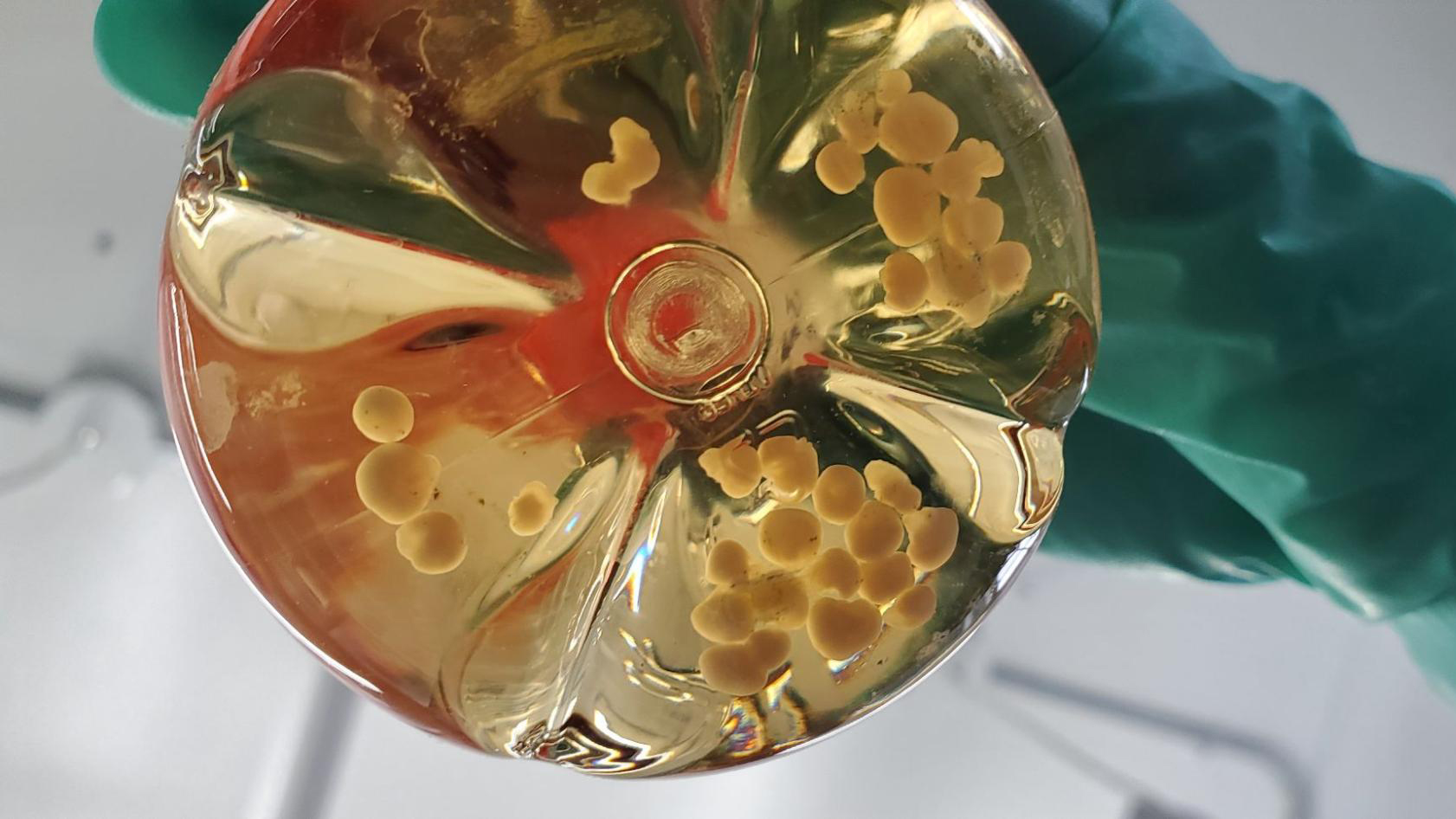
Колба с человеческими мозговыми органоидами
Это помогает искать ответы на самые глубокие вопросы: как формируется человеческий мозг, что делает его уникальным по сравнению с мозгом других видов и, хотя это и крайне спорная тема, каковы биологические основы нашего сознания.
Могут ли органоиды начать думать
Сама идея «мозга в пробирке» неизбежно порождает тревогу и этические дилеммы. Могут ли эти структуры однажды обрести сознание, почувствовать боль или начать мыслить?
Вопрос сознания
Современные органоиды крайне примитивны. У них нет органов чувств, нет связи с внешним миром, они слишком малы и просто устроены, чтобы в них могло зародиться сознание или способность чувствовать. Однако недавние исследования показали, что в органоидах может возникать сложная электрическая активность, похожая на ЭЭГ недоношенных младенцев.
Это не доказывает наличие сознания, но заставляет задуматься о будущем. Поэтому этики предлагают применять «принцип предосторожности»: раз нет полной уверенности, нужно действовать так, как будто некая форма чувствительности у них может появиться, чтобы избежать потенциального вреда в будущем.
Реальные этические дилеммы
Пока вопрос сознания остаётся гипотетическим, учёные и юристы обсуждают более насущные проблемы:
- Страдание. Где та грань сложности, за которой органоид теоретически сможет испытывать боль? Если такая возможность существует, преднамеренное причинение страданий в ходе эксперимента станет абсолютно неэтичным.
- «Очеловечивание». Учёные уже пересаживают человеческие органоиды в мозг грызунов, чтобы обеспечить им кровоснабжение и лучшее созревание. Это поднимает вопрос о химерах — гибридных существах, чей моральный статус будет неясен. Хотя сами учёные считают опасения по поводу «очеловечивания» животных на данном этапе излишними, эта тема требует законодательного регулирования.
- Право собственности. Кому «принадлежит» органоид, выращенный из клеток конкретного человека? Пациенту, который дал клетки? Лаборатории, которая его создала? Сейчас органоиды считаются патентоспособными изобретениями. Но если они когда-либо будут признаны чем-то большим, чем просто клеточной культурой, их юридический статус как «собственности» может стать серьёзной проблемой.
В итоге
Мозговые органоиды позволяют моделировать болезни, быстрее разрабатывать лекарства и создавать персонализированную терапию. В то же время они ставят перед нами сложные этические вопросы, на которые пока нет простых ответов.
Хотя сегодняшние органоиды относительно простые и лишены сознания, научный прогресс может изменить это очень быстро. Поэтому учёным уже сегодня приходится думать над решением непростых этических дилемм, балансируя на грани между жёстким регулированием и научным прогрессом.